2022年,俄罗斯医疗器械市场规模在7231亿卢布左右。其中,高端医疗器械,如心血管、神经外科植介入器械、呼吸机等重症监护设备主要依赖进口。预计到2025年,俄罗斯医疗器械市场规模将达到约140亿美元。
2022年,中俄贸易逆势增长,经贸合作态势良好,中国继续保持俄罗斯最大贸易伙伴国地位。中国商务部欧亚司副司长王开轩表示,去年中俄贸易额为695.3亿美元,同比增长2.2%,在中国与其他主要贸易伙伴贸易量有所减少的情况下,呈现逆势增长。
2023年1-6月我国对俄罗斯医疗器械出口8.75亿美元,同比增长57.03%,各大类产品出口均大幅增长。
此外,长期被欧美产品垄断的俄罗斯市场受复杂局势影响,某些细分领域产品相比之前供货和售后受挫,给了中国企业和产品进入俄市场的机会。今年俄罗斯本土一些综合及专业性展会、学术会议中中国医疗企业明显增多,中俄医疗领域的交流与合作发展空间提升。因此,当下无疑是中国企业开拓俄罗斯市场的重大机会。
联邦医疗监督服务局(FSSH)的职责
俄罗斯联邦医疗监督管理局【Roszdravnadzor,也简称”FSSH(Federal Service for Surveillance in Healthcare)”】由俄罗斯联邦总统于2004年3月9日颁布法令成立,是一个负责管理和监督医疗保健系统的联邦执行机构。俄罗斯医疗器械注册普遍称为“RZN注册”。
无论俄罗斯境外企业或者俄本土制造商申请RZN注册都需要受FSSH的审核和监管。包括技术资料审核、本土企业审厂(境外企业目前只需提供体系证书即可,无需审厂)、技术问题的审核发补、证书的颁发等等。
俄罗斯的注册路径到底怎么选比较合适?(三种路径)
路径1:常规注册(自2013年1月1日起,实行第1416号政府法令和补充规定)
路径2:简化(又称加速)注册(自2022年至2025年,第552号政府法令和附加条款,“通知程序”)
路径3:EAEU注册(自2017年起,由欧亚经济委员会理事会第46号决定)
即便目前公开有以上三种注册路径可以将医疗器械产品在俄罗斯上市,但实际上,目前俄罗斯境外的制造商申请俄罗斯注册的话,我们建议还是选择常规注册路径比较合适。理由如下:
1. 简化注册
主要是为了预防医疗物资紧缺而出台的政策,由于俄罗斯的法规经常写得不够明确从而难以理解,实际上简化注册对中国的制造商而言,目前并没有起到多大的作用。
2. EAEU(欧亚经济联盟)注册
欧亚经济联盟共五个国家分别是俄罗斯、白俄罗斯、哈萨克斯坦、亚美尼亚和吉尔吉斯斯坦,俄罗斯以1.47亿人口占比79%,其余四国仅3820万人口占比21%;EAEU的注册周期基本在2年以上,从2017年至今,只有33个产品获得了EAEU注册,可见其难度之高。根据人口比例情况、市场份额情况、国瑞中安集团的市场调研以及对法规的解读,目前我们并不推荐走EAEU注册(难度更大、费用更高、周期更久。不过,如果您依然想申请EAEU注册的话,我们也可以协助您进行EAEU注册)。另外,俄罗斯的注册证是长期有效的,即使完全实行了EAEU,也不会取消俄罗斯的注册证书。
3. 常规注册的流程
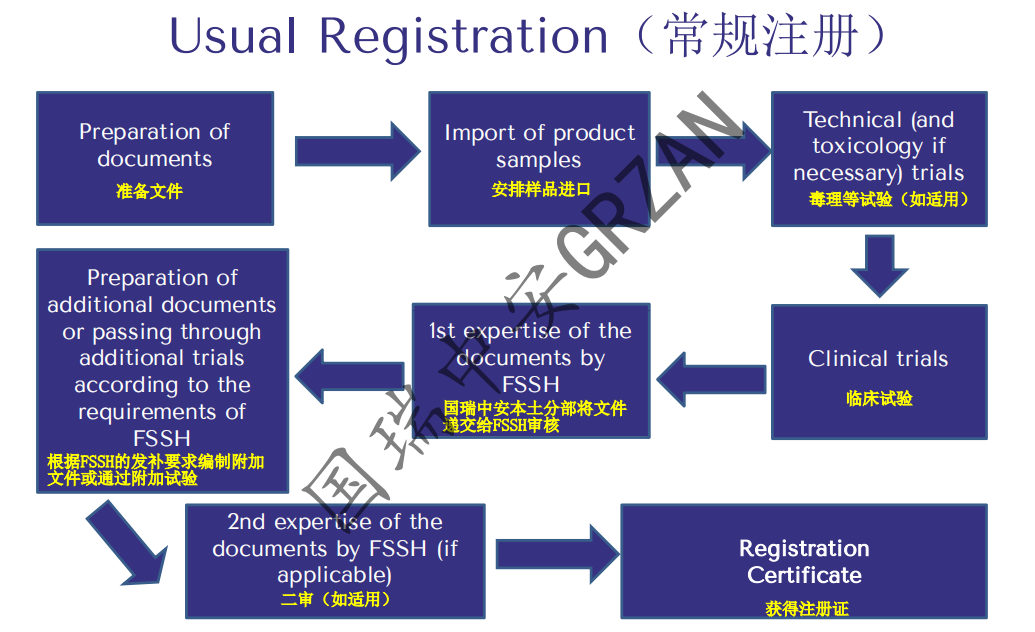
• 俄罗斯的注册确实有一定的难度,即便是俄罗斯的常规注册路径周期也不短,普遍需要12-18个月的时间(部分风险等级较低的产品获证周期可能缩短),但常规注册路径仍然是实际操作中最为推荐的路径。
• 重要流程以及相关的费用组成:
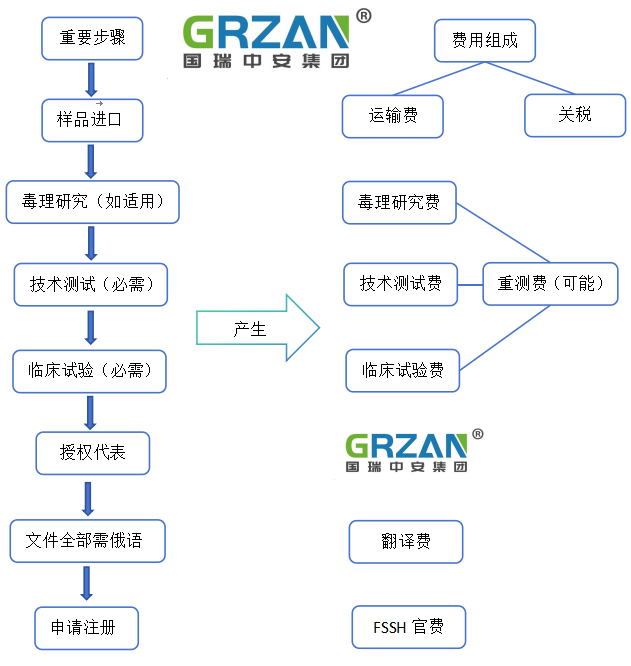
注:
a. 所有的文件需要进行俄语翻译并由公证人进行公证。
b. 在俄罗斯,所有的医疗器械产品都需临床试验,这一点容易造成大家的不理解。低风险产品的临床试验是在实验室开展,在完成技术测试后无需经过FSSH的审批可立即开展临床试验,低风险的产品并非必须进行人体试验,主要会进行类比试验,您可以将其理解为是技术指标/性能的一部分。
对于所有IVD产品,人体样本(血液,尿液,鼻拭子等)的临床试验是强制性要求。
国瑞中安集团可以为企业提供临床试验服务,作为注册过程的一部分。
俄罗斯注册需提供的技术文件清单
1. 公司注册信息(摘自法律实体登记册)
2. 公司营业执照
3. 制造商给俄罗斯本地授权代表的授权书
4. CE认证证书或CE声明(如有)
5. 医疗器械的符合性声明
6. ISO 13485体系证书(如果可能的话,还有ISO 9001也提供)
7. 服务手册
8. 操作员手册
9. 材料声明
10. 基本原则符合性检查表
11. 风险管理文件
12. 产品数据表
13. 如果设备或配件与人的皮肤接触,制造商还应准备用于毒理学的“毒理学材料”试验,在医疗器械无菌的情况下,需要提供灭菌方法和灭菌验证的报告。
14. 软件测试报告(如适用)
15. EMS测试报告(如适用)
16. 另一份关于仪器的报告(如适用)
17. 医疗器械及其所有附件的外观图片(最小尺寸为18厘米x24厘米)
18. 对于临床试验,制造商应该准备来自国外的临床综述资料。(除俄罗斯以外的任何国家)
注意:所有文件应由公证人和认证(CCPIT)保证。
俄罗斯注册问答环节
1. 俄罗斯对于体系有什么要求?
答:所有风险等级都需要提供ISO13485体系证书。
2. 是否需要现场审核工厂?
答:目前是不需要的,在这方面对于境外制造商反而是便利的;境外制造商只需要提供ISO13485体系证书。然而针对俄罗斯境内的制造商,则需要审厂并且要求提供质量管理体系的所有文件。
3. 俄罗斯要求有当地授权代表吗?
答:必须有当地授权代表,当地授权代表可选俄罗斯-国瑞中安 GRZAN GROUP LLC,授权代表在注册过程中起到了不可忽视的作用,需要代表企业去完成注册。
优势:您可以全权委托国瑞中安俄罗斯公司办理俄罗斯注册所涉及的所有本土业务。
4. 俄罗斯的技术测试、毒理测试、临床试验有要求在俄罗斯本土开展吗?
答:必须在俄罗斯开展测试和临床,如有境外高风险或植入产品的临床数据请提供,可以争取简化临床试验。对于低风险级别的1类医疗器械,应在获得临床前试验(技术测试和毒理测试)的测试报告后立即启动临床试验。而对于2a,2b和3风险类设备,临床试验应在获得Roszdravnadzor的临床试验许可批准后启动。另外,如果设备或配件与人的皮肤接触,也必须在俄罗斯本地开展毒理测试。
5. 俄罗斯注册证书有效期几年?
答:请注意,这里重点关注一下,俄罗斯的注册投入可以说是一劳永逸的,性价比极高!因为目前俄罗斯的医疗器械注册证是无期限限制的,这是办理俄罗斯注册证的一大优势。
.png)
(左:林海涛先生 ;右:尤里博士)

国瑞中安集团在俄罗斯本地具有专业的本地化团队,可协助您在俄罗斯注册医疗器械及体外诊断产品,同时,我们俄罗斯分公司GRZAN GROUP LLC还可作为您的本地授权代表,代表您在俄罗斯联邦境内医疗产品流通问题的利益,包括符合性评估程序和国家注册问题,可以为您解决及完成申请、获得医疗产品注册证书。另外,我们的本地化团队还可以协助您产品的清关、境内运输事宜,真正实现俄罗斯注册的一站式、全方位服务。
一带一路”市场准入专项服务
“一带一路”沿线国家近些年已经成为我医疗器械出口主要市场,占我出口量的30%以上,其中东盟国家出口占比最大,而俄罗斯市场增长迅猛。
2023 年上半年医疗器械出口“一带一路”前十大市场:

为响应国家“一带一路”的战略发展布局,国瑞中安集团重磅推出 “一带一路”沿线重点国家的注册专项服务,助力中国企业快速开拓一带一路国际市场。
.png)
.jpg)


